Kwasy karboksylowe- cz. I
Budowa:
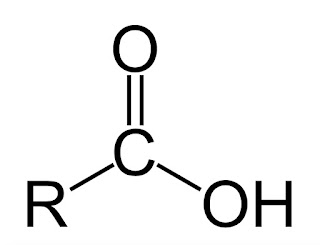
grupa węglowodorowa+ grupa karboksylowa
Grupa karboksylowa składa się z dwóch elementów:
W efekcie wychodzi nam COOH.
Wzór ogólny:
Kwasy możemy podzielić także ze względu na ilość grup karboksylowych:
A) monokarboksylowe- jedna grupa COOH;
B) polikarboksylowe- wiele grup COOH;
Nazewnictwo kwasów:
Kwas + liczba węgli (pamiętaj, aby policzyć także ten obecny w grupie COOH do ogólnej liczby!) + owy
W przypadku aromatycznych kwasów sprawa wygląda trochę inaczej:
Kwas + cyklo + liczba węgli / benzeno +karboksylowy
Ktoś się pewnie teraz zastanawia- dlaczego te kwasy to na przykład nie kwas benzenokarboksylowy?
Wiadomo, chemicy lubią sobie ułatwiać. Niektóre nazwy popularnych kwasów mają dziesiątki lokantów(to te cyferki!) i jeszcze więcej podstawników(to grupy funkcyjne- dla przykładu -CH3 czy -OH). Dlatego sprawę załatwiono nadając kwasom nazwy zwyczajowe. Które koniecznie trzeba znać. 😔
HCOOH- kwas metanowy- kwas mrówkowy
CH3COOH- kwas etanowy- kwas octowy
C2H5COOH- kwas propanowy-kwas propinowy
C3H7COOH- kwas butanowy- maslowy
C4H9COOH-kwas pentanowy- walerianowy
Mrówka przyniosła ocet z masłem dla Walerii. - może w ten sposób zapamiętać?;)
Mrówka przyniosła ocet z masłem dla Walerii. - może w ten sposób zapamiętać?;)
Ważne! Liczenie węgli zaczynamy od węgla przy, którym znajduję się grupa karboksylowa!
Reakcje:
A. Otrzymywanie:
-utlenianie węglowodorów:
2CH4 +3 O2 -> 2 HCOOH + 2 H2O
-utlenianie alkoholi I-rzędowych(czyli takich w których -OH jest przyłączone do węgla, który łączy się tylko z jednym węglem) w obecności K2Cr2O7/ KMnO4:
R-CH2OH + 2 (O) —> R-COOH + H2O
-próby Tollensa i Trommera( o samych próbach przygotuję osobny post) w aldehydach:
HCHO + 2 Ag[NH3]2+ + 3 OH - —> 2 Ag (słynny efekt lustra na probówkach) + HCOO- + 4 NH3 + 2 H2O
-CO2 + węglowodory nienasycone( te z podwójnym lub potrójnym wiązaniem!);
B. Cechy charakterystyczne:
1. Kwas mrówkowy- ciecz, bezbarwna, nieograniczenie rozpuszcza się w wodzie, odczyn kwasowy2.
2. Kwas octowy- ciecz, ostry zapach, nieograniczenie rozpuszcza się w wodzie, odczyn kwasowy
2. Kwas octowy- ciecz, ostry zapach, nieograniczenie rozpuszcza się w wodzie, odczyn kwasowy
3. Kwas oleinowy- pomarańczowy, oleista ciecz, w wodzie tworzy emulsję
4. Kwas- stearynowy- biały, stały, bezwonny, nie rozpuszcza się w wodzie, gęstość mniejsza od wody
5. Kwas benzeosowy- biały, stały, bezwonny, nierozpuszczalny w wodzie, gęstość większa niż wody
C. Reakcje charakterystyczne:
- Kwas etanowy + magnez —> etanian magnezu
2 CH3COOH + Mg —> (CH3COO)2Mg + H2
- Kwas etanowy + tlenek miedzi (II)
- Kwas etanowy + wodorotlenek sodu + fenoloftaleina —> etanian sodu
CH3COOH + NaOH —> CH3COONa + H2O - kolor malinowy!
- Fluorowcowanie pod wpływem światla —> kwas chloroetanowy
CH3COOH + Cl2 —> CH2CL-COOH + HCl
W kolejnej części kolejne reakcje, zastosowania oraz reakcje redoks z udziałem kwasów!
W kolejnej części kolejne reakcje, zastosowania oraz reakcje redoks z udziałem kwasów!







Brak komentarzy:
Prześlij komentarz